Transcitosi
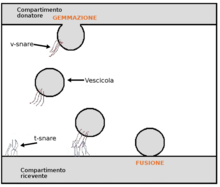
La transcitosi è un processo cellulare attraverso il quale diverse macromolecole vengono trasportate da un lato all'altro della cellula attraverso il citoplasma della cellula stessa. Le macromolecole vengono incluse in vescicole a livello della membrana cellulare mediante un processo di endocitosi, internalizzate nella cellula, e quindi rilasciate attraverso la membrana cellulare in un compartimento diverso da quello di origine, attraverso un processo di esocitosi. Nel corpo umano, macromolecole che possono essere trasportate in questo modo sono le IgA[1], la transferrina[2] e l'insulina[3].
Nonostante la transcitosi sia più comunemente osservata a livello degli epiteli, questo processo è presente anche altrove, come a livello dell'endotelio dei capillari[4], nei neuroni[5], negli osteoclasti[6] e nelle cellule M dell'intestino[7].
Regolazione
[modifica | modifica wikitesto]La regolazione della transcitosi varia enormemente a seconda del tessuto in cui il processo avviene, e sono stati identificati numerosi meccanismi tessuto-specifici. La brefeldina A, un inibitore del trasporto endocellulare dall'apparato di Golgi al reticolo endoplasmatico, è stato osservato inibire anche la transcitosi a livello del rene del cane[8]. Sempre nel tessuto renale canino, a livello della membrana apicale, un ruolo inibitorio è stato osservato nelle proteine Rab17[9], Rab11a e Rab25[10]. Un ruolo inibitorio è stato osservato nella trasduzione del segnale mediante fosforilazione del recettore del fattore di crescita dell'epidermide (EGFR) da parte dell'enzima Yes1 conseguente all'attivazione di Rab11FIP5 da parte di MAPK1[11].
Nel coniglio l'azione combinata di progesterone ed estradiolo, prodotti in seguito a stimolazione dovuta alla prolattina, si è dimostrata inibire la transcitosi nelle cellule della ghiandola mammaria durante la gravidanza[12].
Nella tiroide, la transcitosi attraverso le cellule follicolari è regolata positivamente dall'ormone tireostimolante (TSH). Nei vasi polmonari, la fosforilazione della caveolina 1 indotta dal perossido di idrogeno si è dimostrata fondamentale nell'attivazione della transcitosi[13]
Ruolo patogenetico
[modifica | modifica wikitesto]Per via della funzione della transcitosi come meccanismo di trasporto attraverso la cellula, questa può essere un meccanismo conveniente per l'invasione tissutale da parte di agenti patogeni. Tale meccanismo si è rivelato fondamentale per permettere il passaggio dell'epitelio intestinale e della barriera emato-encefalica da parte del batterio Cronobacter sakazakii[14]. È stato dimostrato che la Listeria monocytogenes attraversa la barriera intestinale mediante transcitosi nelle cellule caliciformi mucipare[15]. Inoltre la tossina di Shiga prodotta dall'Escherichia coli enteroemorragico è stata osservata passare nel lume intestinale mediante transcitosi[16].
Note
[modifica | modifica wikitesto]- ^ (EN) Perez, et al., Investigation of endosomal compartments involved in endocytosis and transcytosis of polymeric immunoglobulin A by subcellular fractionation of perfused isolated rat liver., in Biochem J, vol. 251, n. 3, 1988, pp. 763-70.
- ^ (EN) Fishman, et al., Receptor-mediated transcytosis of transferrin across the blood-brain barrier., in J Neurosci Res, vol. 18, n. 2, 1987, pp. 299-304.
- ^ (EN) Duffy, et al., Blood-brain barrier transcytosis of insulin in developing rabbits., in Brain Res, vol. 420, n. 1, 1987, pp. 32-8.
- ^ (EN) Williams, et al., Endocytosis and exocytosis of protein in capillary endothelium., in J Cell Physiol, vol. 120, n. 2, 1984, pp. 157-62.
- ^ (EN) Fabian RH, Retrograde axonal transport and transcytosis of immunoglobulins: implications for the pathogenesis of autoimmune motor neuron disease., in Adv Neurol, n. 56, 1991, pp. 433-44.
- ^ (EN) Salo, et al., Removal of osteoclast bone resorption products by transcytosis., in Science, vol. 276, n. 5310, 1997, pp. 270-3.
- ^ (EN) Landsverk T, The follicle-associated epithelium of the ileal Peyer's patch in ruminants is distinguished by its shedding of 50 nm particles., in Immunol Cell Biol, vol. 65, n. 3, 1987, pp. 251-61.
- ^ Taub ME, Shen WC, Regulation of pathways within cultured epithelial cells for the transcytosis of a basal membrane-bound peroxidase-polylysine conjugate, in J. Cell. Sci., 106 ( Pt 4), dicembre 1993, pp. 1313–21, PMID 8126110.
- ^ Hunziker W, Peters PJ, Rab17 localizes to recycling endosomes and regulates receptor-mediated transcytosis in epithelial cells, in J. Biol. Chem., vol. 273, n. 25, giugno 1998, pp. 15734–41, PMID 9624171.
- ^ Casanova JE, Wang X, Kumar R, et al., Association of Rab25 and Rab11a with the apical recycling system of polarized Madin-Darby canine kidney cells, in Mol. Biol. Cell, vol. 10, n. 1, gennaio 1999, pp. 47–61, PMC 25153, PMID 9880326.
- ^ Su T, Bryant DM, Luton F, et al., A kinase cascade leading to Rab11-FIP5 controls transcytosis of the polymeric immunoglobulin receptor, in Nat. Cell Biol., vol. 12, n. 12, dicembre 2010, pp. 1143–53, DOI:10.1038/ncb2118, PMC 3072784, PMID 21037565.
- ^ Rosato R, Jammes H, Belair L, Puissant C, Kraehenbuhl JP, Djiane J, Polymeric-Ig receptor gene expression in rabbit mammary gland during pregnancy and lactation: evolution and hormonal regulation, in Mol. Cell. Endocrinol., vol. 110, n. 1-2, aprile 1995, pp. 81–7, PMID 7672455.
- ^ Sun Y, Hu G, Zhang X, Minshall RD, Phosphorylation of caveolin-1 regulates oxidant-induced pulmonary vascular permeability via paracellular and transcellular pathways, in Circ. Res., vol. 105, n. 7, settembre 2009, pp. 676–85, 15 p following 685, DOI:10.1161/CIRCRESAHA.109.201673, PMC 2776728, PMID 19713536.
- ^ Giri CP, Shima K, Tall BD, et al., Cronobacter spp. (previously Enterobacter sakazakii) invade and translocate across both cultured human intestinal epithelial cells and human brain microvascular endothelial cells, in Microb. Pathog., vol. 52, n. 2, febbraio 2012, pp. 140–7, DOI:10.1016/j.micpath.2011.10.003, PMID 22023990.
- ^ Nikitas G, Deschamps C, Disson O, Niault T, Cossart P, Lecuit M, Transcytosis of Listeria monocytogenes across the intestinal barrier upon specific targeting of goblet cell accessible E-cadherin, in J. Exp. Med., vol. 208, n. 11, ottobre 2011, pp. 2263–77, DOI:10.1084/jem.20110560, PMID 21967767.
- ^ Lukyanenko V, Malyukova I, Hubbard A, et al., Enterohemorrhagic Escherichia coli infection stimulates Shiga toxin 1 macropinocytosis and transcytosis across intestinal epithelial cells, in Am. J. Physiol., Cell Physiol., vol. 301, n. 5, novembre 2011, pp. C1140–9, DOI:10.1152/ajpcell.00036.2011, PMID 21832249.
Bibliografia
[modifica | modifica wikitesto]- Stryer, Berg, Biochimica, Bologna, Zanichelli, 2003, ISBN 88-0807-893-0.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su transcitosi
Wikimedia Commons contiene immagini o altri file su transcitosi