Malattie trasmesse da zecche
| Malattie trasmesse da zecche | |
|---|---|
 | |
| Specialità | infettivologia |
| Eziologia | tick bite |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 066.1 |
| MeSH | D017282 |
| eMedicine | 786652 |
Le malattie trasmesse dalle zecche sono patologie nell'uomo o nell'animale causate, patogenesi diretta, o veicolate, patogenesi indiretta, da varie specie di artropodi comunemente chiamati zecche.
La prima evidenza che le zecche fossero in grado di trasmettere microrganismi patogeni risale alla fine dell’800, quando (1893) Kilbourne, un veterinario americano, riscontrò come l'habitat della zecca del bovino, Boophilus microplus, coincidesse con i limiti territoriali di diffusione della cosiddetta febbre bovina del Texas. Contemporaneamente a Kilbourne, Smith, un giovane medico del Bureau of Animal Industry, individuò il protozoo Babesia bigemina (Pyrosoma bigeminum) come agente causale della febbre del Texas, oggi chiamata "babesiosi bovina". La scoperta della patogenicità indiretta nelle malattie trasmesse dalle zecche e delle relazioni tra "agente patogeno-zecca-ospite vertebrato" da alcuni autori è considerata una delle maggiori scoperte nella storia della medicina.[1][2]
Le malattie trasmesse dalle zecche rivestono una notevole importanza, economica e sanitaria, in campo zootecnico ma sta aumentando la loro incidenza anche a livello umano, sia a causa dei cambiamenti ecologici che determinano una maggiore distribuzione delle zecche, sia per un maggiore interesse per le attività all'aperto che pongono più frequentemente l’uomo a contatto con le zecche vettrici.
Nell'uomo si tratta per lo più di patologie infettive, zoonosi, veicolate dal morso o puntura della zecca mentre negli animali sono note patologie, come l'epatozoonosi, dovute all'ingestione di zecche infette. È possibile l'infezione nell'uomo dovuta all'ingestione di latte non pastorizzato ricavato da animali infetti.
Poiché le singole zecche possono ospitare più di un agente patogeno, l'uomo o animale può essere infettato da più di un agente patogeno contemporaneamente, aggravando la difficoltà di diagnosi e trattamento.[3][4][5][6][7][8][9]
Le zecche
[modifica | modifica wikitesto]

Le zecche sono artropodi, appartenenti all’ordine degli Ixodidi compreso nella classe degli Arachnidi, la stessa di ragni, acari e scorpioni. Si tratta di ectoparassiti ematofagi obbligati, cioè che vivono all'esterno del corpo dell'organismo ospite nutrendosi del suo sangue. Possono nutrirsi del sangue di mammiferi, uccelli o rettili. Le zecche sono diffuse in tutto il mondo e se ne conoscono circa 900 specie raggruppate in tre famiglie, di cui le principali sono le Ixodidae (zecche dure di cui al 2013 sono state classificate 702 specie) e le Argasidae (zecche molli di cui al 2013 sono state classificate 193 specie). Il loro sviluppo si svolge attraverso 4 stadi: uovo >larva >ninfa >adulto.
Hanno dimensioni che variano da qualche millimetro a circa 1 centimetro secondo la specie e lo stadio di sviluppo. L’apparato boccale, di tipo pungente succhiatore, è costituito dal rostro o capitulum, con un robusto ipostoma con denti rivolti all'indietro. La dentatura dell'ipostoma con l'aggiunta di una sostanza collosa che viene secreta assieme alla saliva comportano che le ixodidae, ixos in greco significa "colla", restino ancorate alla pelle dell'ospite e non sia semplice rimuoverle. Il capitulum delle zecche, al contrario di quello degli acari, è mobile.[10]
Gli Ixodida sono i soli acari in cui l’assunzione di sangue condiziona la muta degli stadi immaturi a quelli successivi. Nel loro ciclo biologico alcune specie di zecche cambiano l'animale ospite da cui succhiare il sangue utilizzando individui diversi per cibarsi ad ogni stadio. Nel passaggio da un animale ospite all'altro il primo può assumere il ruolo di "serbatoio" degli agenti patogeni.
Le zecche dure hanno un caratteristico scudo dorsale chitinoso e comprendono 5 generi: Ixodes, Hyalomma, Rhipicephalus, Dermacentor, Haemaphysalis. Le zecche molli, così dette perché sprovviste di scudo dorsale, sono presenti con due generi: Argas e Ornithodorus. Queste ultime generalmente scelgono gli uccelli come animale ospide da cui succhiare il sangue. La più comune in Italia risulta essere Argas reflexus detta anche “zecca del piccione”.[1][11] Le specie più diffuse e rilevanti da un punto di vista sanitario sia in Italia che in Europa sono Ixodes ricinus (la zecca dei boschi), Rhipicephalus sanguineus (la zecca del cane), Hyalomma marginatum e Dermacentor reticulatus.[12]
La saliva delle zecche è una miscela complessa con varie funzioni. Subito dopo la perforazione della pelle dell'ospite, le zecche secernono un materiale bianco lattiginoso, simile al lattice, chiamato "cemento", che si indurisce formando un cono che circonda l'ipostoma.[13][14]
Ulteriori secrezioni nelle successive 48-72 ore aggiungono strati al cono di cemento; in alcune specie questa secrezione aggiuntiva di cemento scorre sulla pelle dell'ospite per rafforzare ulteriormente il punto di ancoraggio del parassita.
La composizione chimica del cemento consiste in una miscela di proteine antigeniche e non antigeniche, con lipidi e carboidrati negli strati più interni, questi ultimi principalmente nella forma di lipo- e glicoproteine. A seguito della creazione del cono di cemento, le ghiandole salivari della zecca si espandono e la sintesi proteica accelera.[13][14]
Il pasto, la suzione del sangue dell'ospite, è accompagnato da una copiosa secrezione di liquidi salivari. Oltre ai precursori del cemento nelle cellule secretorie delle ghiandole salivari delle zecche stata identificata una varietà di enzimi.
Le ghiandole salivari delle zecche secernono anche molte sostanze farmacologicamente attive, inclusi anticoagulanti, prostaglandina E2 (PGE2) e prostaciclina, vasodilatatori, agenti antinfiammatori, antistaminici (in alcune specie) e altri. In alcune specie, vengono secreti gli enzimi che distruggono le bradichinine e le anafilotossine, proteine ospiti che svolgono un ruolo cruciale nella modulazione della risposta infiammatoria. In alcune comuni associazioni ospite / parassita agenti salivari sopprimerebbero componenti del sistema immunitario ospite, ad esempio cellule T, riducendo così al minimo la capacità di rigetto.[14]
Alcune zecche, in alcuni ospiti, sarebbero in grado di modulare la risposta immunitaria dell'ospite regolando l'andamento dell'infestazione stessa e nel caso di trasmissione di un agente infettante ne possono favorire la sopravvivenza.
Rischio di infezione
[modifica | modifica wikitesto]La straordinaria capacità delle zecche nel trasmettere agenti patogeni è stata messa in relazione con le modalità con cui le zecche si alimentano e con la composizione dei secreti salivari e delle feci. La sequenza tipica di trasmissione dell'agente infettivo si può sintetizzare con:
zecca non infetta → ospite infetto → zecca infetta → infezione di un nuovo ospite nel corso del successivo pasto di sangue.
Si riscontra anche la trasmissione dell'agente patogeno da zecca infetta a zecca non infetta quando più zecche si alimentano contemporaneamente e raggruppate da uno stesso ospite non infetto, fenomeno chiamato co-feeding.

Gli ospiti infetti come le zecche stesse possono assumere con certi agenti patogeni il ruolo di reservoir (serbatoio di riserva): cioè in grado di consentire la sopravvivenza del patogeno in periodi in cui non è possibile la sua trasmissione (esempio: nel corso dell’inverno quando le zecche non sono attive). Quando il reservoir è un ospite vertebrato, questo deve presentare periodi più o meno lunghi o picchi stagionali, durante i quali il patogeno è presente nella circolazione sanguigna. I piccoli roditori selvatici sono efficienti reservoir per numerosi agenti batterici e virali. La funzione di reservoir delle zecche stesse può essere assicurata dalla trasmissione transtadiale (trasmissione orizzontale ad esempio da ninfa ad adulto) e transovarica (trasmissione verticale da adulto a uova) del patogeno.
Durante l'atto di suzione, la zecca rigurgita regolarmente i resti indigesti del cibo nel suo ospite. In particolare in questo processo, i patogeni (batteri, virus, protozoi, vermi) precedentemente ingeriti da un precedente ospite e mantenuti o addirittura replicati nel corpo della zecca possono essere trasferiti all'ospite successivo. Gli agenti patogeni si trovano generalmente nel tratto intestinale della zecca infettata e non vengono trasmessi all'ospite vertebrato immediatamente con la puntura, ma a volte solo dopo qualche ora (nella malattia di Lyme per esempio, circa 6 a 24 ore dopo la puntura). Per questo, la rimozione più rapida e attenta della zecca è fortemente consigliata per ridurre il rischio di infezione.[15]
Anche lo stadio di sviluppo della zecca ha un'influenza sul rischio di infezione. Una zecca nello stadio di ninfa può contenere dieci volte più patogeni di una zecca adulta. La saliva ed il rigurgito alimentare della zecca possono contenere agenti patogeni (virus, batteri, protozoi, elminti) che la zecca ha assunto insieme al sangue durante una precedente ingestione da un ospite infetto. Se questi patogeni non solo sopravvivono nella zecca, ma si moltiplicano o si modificano, la zecca diviene il veicolo di trasmissione di varie malattie infettive agli umani e a tutti i tipi di specie di vertebrati.[4][16][17][18][19]
Rischi di natura non infettiva
[modifica | modifica wikitesto]Alcune specie di zecche secernono sostanze tossiche anche letali nei loro ospiti vertebrati. Fra queste patologie, la principale è la paralisi da zecca che induce nell’ospite una paralisi motoria provocata dall’introduzione di sostanze tossiche.
Il potenziale per indurre la paralisi è stato dimostrato, descritto o sospettato in oltre 60 specie di zecche. La maggior parte appartengono agli Ixodidae, ma anche alcune specie di Argasidae sono state identificate come agenti della paralisi. Sulla costa orientale dell'Australia, la Ixodes holocyclus (e in misura minore I. cornuatus e I. hirstii ) causa la forma più grave di paralisi delle zecche, con una mortalità nei cani da cui non viene rimossa la zecca che può raggiungere il 10%.
In Nord America, la Dermacentor andersoni e la D. variabilis sono le cause più comuni. Il cane sembra essere il solo animale suscettibile alla tossina di Dermacentor spp.[20] Ovini, bovini e persone possono essere colpiti, così come i cani se morsi da I. scapularis, Amblyomma americanum, A. maculatum, R. sanguineus e O.megnini. Le zecche Argas radiatus e A persicus hanno causato la paralisi nei gallinacei. In Africa, la I.rubicundus (paralisi da zecche Karoo) e R punctatus in Sud Africa, R. evertsi e Argas walkerae nell'Africa sub-sahariana, e R.evertsi mimeticus in Namibia possono causare la paralisi.
La I.olocyclus in Australia causa una malattia molto più grave di quella osservata in Nord America e altrove. Sono colpiti cani e gatti, pecore, capre, vitelli, puledri, cavalli, maiali, volpi, volatili, pollame, uccelli (struzzi), rettili (serpenti e lucertole) e persone. Si osservano sia la paresi locale (meno comune) che quella sistemica e la paralisi. Gli ospiti reservoir sono raramente colpiti, presumibilmente per una immunità acquisita in tenera età.[20][21]
Sono note altre tossicosi da zecca. Le più comuni sono state associate al morso di zecche Argasidae.[22][23] In Africa il morso di Ornithodoros savignyi può causare la morte dell'animale in meno di un giorno.[24] Gravi tossicosi, nello stesso continente, si possono verificare nell’uomo in seguito al morso di Argas brumpti e Ornithodoros moubata. In Messico e negli USA occidentali l’agente principale di tossicosi da zecca è Ornithodoros coriaceus e un altro Argasidae (Ornithodoros lahorensis) è stato individuato come causa di tossicosi nelle pecore nell’est dell’Europa. I sintomi includono tremori, saliva schiumosa, digrignamento dei denti e solo raramente paralisi.[25]
Il morso della zecca può essere spesso seguito da un’infezione cutanea localizzata (caratterizzata da eritema, edema e dolore) causata dalla penetrazione in profondità di batteri presenti abitualmente sulla superficie dell’epidermide, tra cui i più comuni sono streptococchi o stafilococchi.[26]
Il morso di zecca può causare inoltre una grave reazione allergica che si esprime con un’immediata reazione di ipersensibilità IgE-mediata verso gli allergeni della zecca.[27][28] Negli ultimi dieci anni, la zecca stella solitaria, Amblyomma americanum, una zecca di medie dimensioni, bruno-rossastro comune negli Stati Uniti sudorientali, è stata considerata come la probabile causa di gravi allergie alle carni rosse, che sono aumentate nell'incidenza. Questa allergia è stata riscontrata in Nord America, Europa, Asia, America centrale e Africa. Si crede che la zecca stella solitaria produca un glucide chiamato galattosio-alfa-1,3-galattosio, che viene iniettato nell'ospite durante il morso della zecca. Il glucide si trova poi anche nella carne rossa (ad es. carne di manzo, maiale, selvaggina, coniglio) e in alcuni prodotti caseari. Questa allergia può causare sintomi che vanno dall'orticaria all'angioedema e all'anafilassi. È stato anche segnalato lo shock anafilattico ritardato che si verifica 4-6 ore dopo il consumo di carne rossa.
La zecca per nutrirsi taglia e penetra la cute con l'ipostoma, traumatizzando i tessuti dell'animale ospite e stimolando, in esso, una risposta infiammatoria.[29][30][31]
L'infiammazione viene determinata, oltre che dall'azione meccanica, anche dall’azione irritante della saliva del vettore che induce l’attivazione piastrinica, la liberazione d'istamina e serotonina, che insieme alla bradichinina, prodotta in risposta al danno cellulare, determinano vasodilatazione, aumento della permeabilità vasale e dolore. Per contrastare alcuni di questi effetti, la zecca, tramite la saliva, introduce delle sostanze anticoagulanti, prostaglandine (PGE), prostacicline e sostanze antistaminiche, con la funzione di inibitori dell'aggregazione piastrinica, vasodilatori e antagonisti dell'emostasi. Contemporaneamente, per poter rimanere attaccata all'ospite, la zecca utilizza degli specifici composti che inattivano i mediatori chimici responsabili dei processi infiammatori nell'ospite.
L'attacco della zecca stimola in quest’ultimo una serie di reazioni consequenziali attivate dalla penetrazione della zecca nella pelle: infatti questa secerne sostanze con caratteristiche antigeniche che provocano, a livello dei tessuti dell’ospite, un rilascio di mediatori chimici che stimolano l’infiammazione e richiamano cellule infiammatorie, provocando inoltre la degranulazione dei mastociti con liberazione di istamina. Gli antigeni secreti dalla zecca vengono catturati dalle cellule di Langerhans che li presentano ai linfociti T; quest’ultimi rilasciano citochine che determinano la secrezione da parte dei Linfociti B di specifiche IgM, IgG e IgE.[26]
La ferita determinata dalla zecca può peggiorare nel caso di complicazioni batteriche (es. Staphylococcus spp.) o di contaminazione da parte di larve di mosca. Si possono così sviluppare ascessi, anche se questo processo avviene più frequentemente nel caso in cui il rostro della zecca rimanga all'interno del tessuto dell'ospite durante il tentativo di rimozione.
Esiste poi un rischio anemia è legato alla sottrazione di sangue da parte di un numero elevato di zecche da un singolo animale. Ogni zecca è in grado di aumentare fino il a 100 volte il proprio peso corporeo; questo dipende dallo stadio di sviluppo e dalla specie a cui appartiene. Per esempio, le specie appartenenti al genere Amblyomma sono quelle dotate della maggior capacità di sottrarre sangue provocando vari gradi di anemia.[32]
Ogni anno in estate, durante il periodo di massima attività delle zecche, sono riportati casi di anemia soprattutto in cani, la cui gravità dipende dal grado di parassitosi e dalla quantità del sangue sottratto. Nei cani se l'ematocrito raggiunge l’11% si è di fronte ad un caso molto grave, che necessita di trasfusione immediata[33]. La rapidità d'intervento è essenziale; bisognerà eliminare tutti i parassiti ed intervenire con terapie di supporto.
Malattie infettive
[modifica | modifica wikitesto]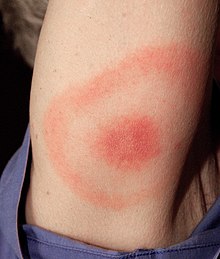
Le zecche sono in grado di trasmettere malattie causate da virus, batteri, protozoi ed elminti. Una rassegna completa di tutti i microrganismi trasmessi da zecche e delle patologie ad essi associate è estremamente complessa, anche riferendosi solo alle patologie che hanno impatto sull'uomo. La distribuzione geografica delle singole patologie varia sensibilmente così come variano geograficamente le genospecie delle zecche vettrici o degli agenti patogeni. Anche per questo vaccini sviluppati per la borreliosi negli USA sarebbero inefficaci per prevenire la borreliosi in Europa. Si deve considerare inoltre l'equilibrio che si crea tra l'infettività dell'agente patogeno e la resistenza degli animali ospiti. La loro distribuzione geografica varia anche per effetto della migrazione aviaria. L’aumento, in certe aree, di alcuni animali che possono fungere da serbatoio delle forme infettive o che semplicemente ospitano le zecche vettrici e i cambiamenti ambientali indotti dalle variazioni climatiche e dall’uomo hanno determinato un aumento della circolazione delle zecche e dei patogeni da loro trasmessi. Alcune malattie trasmesse dalle zecche all'uomo sono state chiaramente identificate solo recentemente (dopo l'anno 2000). Al 2018 sono stati identificati oltre 80 diversi virus che possono essere trasmessi dalle zecche. Molte malattie trasmesse da zecche di notevole rilevanza zootecnica non hanno impatto sulla salute dell'uomo. Quasi tutte le patologie trasmesse dalle zecche possono essere trasmesse per altre vie: punture di altri insetti, ingestione di latte non pastorizzato, trasfusioni di sangue, il morso di animali infetti ecc.. Alcune patologie trasmissibili con la semplice inalazione dell'agente patogeno sono considerate potenziali armi biologiche.[34][35]
Le zecche vettrici più importanti nell'emisfero settentrionale sono le specie del genere Ixodes con le specie autoctone più comuni, la zecca dei boschi, Ixodes ricinus, negli Stati Uniti orientali la Ixodes scapularis, in Russia la Ixodes persulcatus. Altri generi sono Rhipicephalus, Dermacentor, Hafaphysalis, Amblyomma e zecche "molli" dei generi Argas e Ornithodorus.[36][37]
L'ampia gamma di patologie che possono essere trasmesse dalle zecche all'uomo può essere classificata per gruppi fondamentali in funzione dell'agente patogeno: Borreliosi, Piroplasmosi, Rickettsiosi, Anaplasmosi, Babesiosi, Ehrlichiosi ecc.[38]
| Zecche specie Legenda:I.=Ixodes, D.=Dermacentor, O.=Ornithodoros, A.=Amblyomma, Rh.=Rhipicephalus, Hy.=Hyalomma |
Patogeni-Batteri | Malattie (ospiti) Legenda:sfondo bianco nelle principali malattie dell’uomo presenti in Europa e/o nel Nord America[5][6] |
Vertebrati reservoir |
| I. scapularis, I.ricinus, I dentatus, I.pacificus, I.persulcatus | Borrelia burgdorferi sensu lato | Malattia di Lyme (uomo, bestiame, cane, cavallo, coniglio) | Roditore, uccello, rettile |
| I. scapularis, I.ricinus | Borrelia miyamotoi | Borreliosi miyamotoi, una forma di Febbre ricorrente (umani, cervidi) | Roditore, uccello, cervidi |
| Ar. reflexus | Borrelia anserina | Spirochetosi (colombi, umani) | |
| I.scapularis | Anaplasma phagocytophilum | Anaplasmosi granulocitica (sintomi simil-influenzali in umani, bovini, capre, pecore, cavalli, cani, gatti) | Ruminanti selvaggi, roditori |
| A. platys | Anaplasmosi (cane) | ||
| I.scapularis, R.sanguineus, Am. americanum, D. variabilis | Ehrlichia chaffeensis, Ehrlichia ewingii, Ehrlichia muris eauclairensis | Ehrlichiosi (umani) | |
| Bartonella henselae | Malattia da graffio di gatto (umani) | Gatto | |
| Bartonella berkhoffii | Bartonellosi (cane, umani) | Cane | |
| + di 40 specie diverse | Coxiella burnetii | Febbre Q (umani, capra, pecora, ...) | Roditore |
| D. andersoni, D.variabilis oltre 20 specie | Francisella tularensis | Tularemia (umani, roditori, pecore, capre, ...) | lepre |
| D. variabilis, D. andersoni | Rickettsia rickettsii | Febbre maculosa delle Montagne Rocciose | |
| Am. maculatum | Rickettsia parkeri | Febbre (umani, cane) | cane |
| Rickettsia helvetica | Febbre (umani) | ||
| Rickettsia monacensis | Febbre (umani) | ||
| Rickettsia slovaca | Linfadenopatia da zecche / Escare del cuoio capelluto e linfoadenopatia del collo (umani) | ||
| Rickettsia raoultii | Linfadenopatia da zecche / Escare del cuoio capelluto e linfoadenopatia del collo (umani) | ||
| Rh. sanguineus | Rickettsia conorii | Febbre bottonosa mediterranea (umani) | Cane |
| Candidatus Neoehrlichia mikurensis | Febbre (umani, cani) | Roditore | |
| Ehrlichia canis | Ehrlichiosis (cane) | Cane | |
| Patogeni - Protozoi | |||
|---|---|---|---|
| I. ricinus, I. scapularis | Babesia diverge | Babesiosi(umana, bovini) | Cervo, bestiame |
| Babesia microti | Babesiosi (umana) | roditore | |
| Babesia venatorum | |||
| Babesia capreoli | |||
| I. scapularis, I.ricinus | Babesia gibsoni | Babesiosi canina | Cane |
| Babesia caballi | Babesiosi (cavallo) | Cavallo | |
| Babesia canis | Babesiosi canina | Cani | |
| Haemaphysali spp. | Babesia spp. | Babesiosi (umani, possibilmente bovino e cane) | |
| I. scapularis, I.ricinus | Babesia vogeli | Babesiosi canina | Cane |
| D. spp. | Anaplasma ovis | Anaplasmosi (capra, pecora) | |
| Anaplasma marginale | Anaplasmosi bovina (bovini) | Bestiame | |
| Anaplasma platys | Trombocitopenia ciclica | Cane | |
| Theileria / Babesia equi | Teileriosi (cavallo) | Cavallo | |
| Theileria spp. | Teileriosi (bovini) | ||
| Hy. spp. | Theileria annulata | Teileriosi (bovini) | |
| Theileria equi | |||
| I. scapularis, I.ricinus | Hepatozoon canis | Epatozoonosi | Cane |
| Patogeni - Virus | |||
| I. ricinus, I. persulcatus | Virus dell'encefalite da zecche | Meningoencefalite da zecche, TBE (umano, cane) | Roditore |
| Virus emorragico di Omsk | Manifestazioni emorragiche (umani) | ondatra | |
| I.,D.,Hy. | Virus Powassan | Febbre, segni neurologici (umani) | Roditore |
| Virus della febbre emorragica della Crimea-Congo | Febbre emorragica (umani) | Lepre, Riccio, Roditoie, uccelli | |
| D. andersoni | Virus della febbre del Colorado | Febbre da zecca del Colorado (umani) | |
| O. savignyi | Virus della febbre di Alkhumra | Febbre emorragica di Alkhumra (umani) | |
| Hy. spinigera | Virus della malattia della foresta di Kyasanur | Malattia della foresta di Kyasanur | |
| Virus della malattia di Heartland | Malattia di Heartland, segni simili alla anaplasmosi (umani) | ||
| O. moubata, O. erraticus | Virus della peste suina africana | Peste suina africana (suini) | |
| Patogeni - Elminti | |||
| Rh. sanguineus | Cercopithifilaria grassii, Acanthocheilonema reconditum | Filariasi ( cane) |
Profilassi
[modifica | modifica wikitesto]Il modo più semplice per prevenire le malattie trasmesse dalle zecche è quello di ridurre il rischio di infestazioni da zecche[39][41][42].
Profilassi ambientale
[modifica | modifica wikitesto]L'attività delle zecche dipende strettamente da precisi fattori ambientali (temperatura, umidità) e in Europa ad alta quota (sopra i 1200 metri) e nei mesi con temperature particolarmente rigide il rischio di infestazioni da zecche è minimo. Le zone maggiormente a rischio per la possibilità di punture di zecche sono gli ambienti boschivi e ricchi di cespugli, umidi ed ombreggiati, con vegetazione bassa e letti di foglie secche, sono a rischio anche il sottobosco ed i prati incolti, così come le zone di confine tra prato e bosco, soprattutto se con presenza di acqua. Anche i sentieri poco battuti, in cui è maggiore la possibilità di presenza di fauna selvatica, sono da considerare a rischio.
Le misure di profilassi ambientale possono avere uno scarso impatto sui relativi agenti patogeni, considerando la varietà e molteplicità dei possibili serbatoi di infezione.
Disinfestazioni su larga scala non sono pratiche e possono avere un impatto ambientale negativo.
Il rischio di infestazioni di zecche può essere ridotto tagliando l'erba, potando alberi o siepi, rimuovano gli accumuli di scarti vegetali e tenendo puliti prati e sentieri.
La disinfestazione ambientale con acaricidi può essere utile in caso di aree ristrette.
I cani, i gatti ed altri animali domestici che possono essere infestati da zecche possono essere trattati con idonei prodotti antizecche.
Nelle aree ad alto rischio, gli animali selvatici o al pascolo sono spesso massicciamente infestati da zecche. È consigliata la periodica disinfestazione dei ricoveri degli animali e il confinamento delle aree dove potrebbero accedere animali selvatici, escludendo anche agli uccelli l'accesso ai ricoveri per gli animali.
Profilassi comportamentale
[modifica | modifica wikitesto]Chi si reca in aree a rischio per lavoro, escursioni o gioco dovrebbe indossare cappello e vestiti di colore bianco o chiaro. Maniche e pantaloni lunghi, infilando i pantaloni negli stivali o nelle calze.
Gli abiti di colore chiaro oltre a essere meno attrattivi per gli artropodi, facilitano l’individuazione delle zecche.
Sulla pelle esposta e sugli indumenti vanno utilizzati repellenti per insetti, ad esempio N,N-dietil-n-toluamide o Picaridina, che forniscano una protezione per tutto il tempo trascorso nell'area a rischio. Per quanto possibile si deve evitare il contatto con la vegetazione: camminando al centro dei sentieri, evitando di sedersi o sdraiarsi nell'erba ecc. La probabilità di essere infettati dalla puntura di zecche è in genere proporzionale al tempo di permanenza della zecca sull’ospite ed è in genere bassa se la zecca rimane attaccata all’ospite per meno di 24-36 ore. Facendo un bagno o doccia subito dopo (entro 2 ore) essersi esposti in aree a rischio è possibile rimuovere eventuali zecche non ancora ancorate alla pelle.
Un accurato controllo, con l'aiuto di un'altra persona, di tutto il corpo e soprattutto della pelle più esposta e delle zone privilegiate dalle zecche (capelli, inguine, ombelico, ascelle, collo) permette di individuare eventuali zecche ancorate o segni del loro morso. Le zecche ancorate appaiono come piccoli corpuscoli neri o come crosticine che non si rimuovono facilmente. Se l'attacco è dovuto a larve (sembrano un punto di fuliggine) o ninfe (sembrano una scura capocchia di spillo) per riconoscerle adeguatamente può essere utile una lente di ingrandimento. Le eventuali zecche vanno rimosse prima possibile. Non devono essere traumatizzate dall'applicazione di prodotti (solventi, disinfettanti, detergenti, dentifrici) o calore e non devono essere schiacciate al fine di evitare nella zecca il riflesso del rigurgito.
La zecca va afferrata saldamente, il più vicino possibile alla pelle, possibilmente con una pinzetta o strumento analogo. Dovendo usare le dita, evitare il contatto diretto con la zecca, ad esempio utilizzando dei guanti. L'estrazione avviene effettuando una trazione costante e decisa, non brusca.[42]
Che ci sia un beneficio accompagnando alla trazione una delicata rotazione o svitamento per evitare il distacco del rostro dal corpo della zecca è argomento oggetto di controversia.[6][42][43][44] Se dopo l’estrazione, una minima parte del rostro resta nella ferita, di solito la cosa si risolve spontaneamente in un paio di giorni. Il residuo si può comunque estrarre con l’ausilio della punta di un ago sterile. Dopo l’estrazione della zecca sono indicati: la disinfezione della zona (evitando i disinfettanti che colorano la cute) e un periodo di osservazione della durata di 30-40 giorni per individuare la comparsa di eventuali segni e sintomi di infezione. Se si sviluppano sintomi di una malattia trasmessa da zecche si deve immediatamente consultare un medico.
Profilassi specifica
[modifica | modifica wikitesto]Sono stati messi in commercio vaccini contro la Malattia di Lyme ottenuti per lo più con tecniche di ingegneria genetica. L’efficacia e la sicurezza di questi vaccini sono state dimostrate mediante studi clinici controllati su larga scala in persone di età compresa tra 15 e 70 anni. L’efficacia è stata stimata essere di circa il 49% dopo due dosi di vaccino, e di circa il 76% dopo tre dosi. La somministrazione consigliata consiste in tre dosi per via intramuscolare. La durata dell’immunità conferita non è nota. Negli USA è presente solo B.burgdorferi sensu stricto, mentre in Europa sono presenti tutte le genospecie di Borrelie responsabili della malattia, distinte dal punto di vista antigenico. Per questo i primi vaccini commercializzati negli USA non sono utili per la profilassi immunitaria della malattia di Lyme in Europa. È in corso lo sviluppo di vaccini in grado di generare una risposta immune alla maggioranza delle Borrelie responsabili della malattia di Lyme in Europa.[45] È stato sviluppato anche un vaccino contro la TBE, già adottato in molti Paesi dell’Europa centrale e settentrionale.[46] La somministrazione dei vaccini, consigliata nelle aree endemiche ai soggetti a rischio (forestali, raccoglitori di funghi, ecc.), sottostà a precise raccomandazioni per limitare i rischi di reazioni avverse.[6]
I vaccini non registrati, o non ancora commercializzati in Italia, possono essere acquistati all’estero seguendo le procedure stabilite dal Decreto Ministeriale del 11 febbraio 1997.[47]
Note
[modifica | modifica wikitesto]- ^ a b Schwabe, Calvin W., Riemann, Hans P. e Caporale, Vincenzo., Epidemiologia veterinaria, Ed. italiana., Edagricole, 1986c, ISBN 88-206-2041-3, OCLC 878788850. URL consultato il 9 luglio 2018.
- ^ a b ZECCHE COME CAUSA DI ZOONOSI, su elearning.unite.it. URL consultato l'11 luglio 2018 (archiviato dall'url originale l'11 luglio 2018).
- ^ John F. Anderson e Louis A. Magnarelli, Biology of Ticks, in Infectious Disease Clinics of North America, vol. 22, n. 2, 2008-06, pp. 195-215, DOI:10.1016/j.idc.2007.12.006. URL consultato l'8 luglio 2018.
- ^ a b A. ESTRADA-PEÑA, Ticks as vectors: taxonomy, biology and ecology, in Revue Scientifique et Technique de l'OIE, vol. 34, n. 1, 1º aprile 2015, pp. 53-65, DOI:10.20506/rst.34.1.2345. URL consultato il 7 luglio 2018 (archiviato dall'url originale il 1º giugno 2018).
- ^ a b c (EN) CDC - Tick-Borne Diseases - NIOSH Workplace Safety and Health Topic, su cdc.gov. URL consultato l'8 luglio 2018.
- ^ a b c d e Zecche, su epicentro.iss.it. URL consultato l'8 luglio 2018.
- ^ (EN) FAQ: Tick-Borne Diseases, in WebMD. URL consultato l'8 luglio 2018.
- ^ V. Sambri, A. Marangoni e E. Storni, [Tick borne zoonosis: selected clinical and diagnostic aspects], in Parassitologia, vol. 46, n. 1-2, 2004-6, pp. 109-113. URL consultato l'8 luglio 2018.
- ^ Leonardo Calza, Roberto Manfredi e Francesco Chiodo, Le infezioni trasmesse dal morso di zecca (PDF), in Recenti Progressi in Medicina, vol. 95, n. 9, 1º settembre 2004, DOI:10.1701/43.337. URL consultato l'8 luglio 2018 (archiviato dall'url originale il 14 febbraio 2019).
- ^ a b (EN) Tick ID | Tick-borne Diseases | Ticks | CDC, su cdc.gov, 5 giugno 2018. URL consultato il 9 luglio 2018.
- ^ Cristina KHOURY, Michele MAROLI, La zecca del piccione Argas reflexus (Acari: Argasidae) ed i rischi per la salute umana (PDF), in Ann Ist Super Sanità, vol. 40, n. 4, 2004, pp. 427-432. URL consultato l'11 luglio 2018 (archiviato dall'url originale il 12 maggio 2018).
- ^ Cringoli, Giuseppe., Zecche (PDF), Rolando Editore, [2005], ISBN 88-89132-05-1, OCLC 963873591. URL consultato l'8 luglio 2018.
- ^ a b Ladislav Šimo, Maria Kazimirova e Jennifer Richardson, The Essential Role of Tick Salivary Glands and Saliva in Tick Feeding and Pathogen Transmission, in Frontiers in Cellular and Infection Microbiology, vol. 7, 22 giugno 2017, DOI:10.3389/fcimb.2017.00281. URL consultato l'8 luglio 2018.
- ^ a b c Mária Kazimírová e Iveta Štibrániová, Tick salivary compounds: their role in modulation of host defences and pathogen transmission, in Frontiers in Cellular and Infection Microbiology, vol. 3, 20 agosto 2013, DOI:10.3389/fcimb.2013.00043. URL consultato l'8 luglio 2018.
- ^ Christian Perronne, Lyme and associated tick-borne diseases: global challenges in the context of a public health threat, in Frontiers in Cellular and Infection Microbiology, vol. 4, 3 giugno 2014, DOI:10.3389/fcimb.2014.00074. URL consultato l'8 luglio 2018.
- ^ a b Karen L. Mansfield, Lv Jizhou e L. Paul Phipps, Emerging Tick-Borne Viruses in the Twenty-First Century, in Frontiers in Cellular and Infection Microbiology, vol. 7, 11 luglio 2017, DOI:10.3389/fcimb.2017.00298. URL consultato il 10 luglio 2018.
- ^ Doug E Brackney e Philip M Armstrong, Transmission and evolution of tick-borne viruses, in Current Opinion in Virology, vol. 21, 2016-12, pp. 67-74, DOI:10.1016/j.coviro.2016.08.005. URL consultato l'8 luglio 2018.
- ^ a b Goodman, Jesse L., Dennis, David T. (David Tappen), 1939- e Sonenshine, Daniel E., Tick-borne diseases of humans, ASM Press, 2005, ISBN 1-55581-238-4, OCLC 56614466. URL consultato l'8 luglio 2018.
- ^ (EN) P. Parola e D. Raoult, Ticks and Tickborne Bacterial Diseases in Humans: An Emerging Infectious Threat, in Clinical Infectious Diseases, vol. 32, n. 6, 15 marzo 2001, pp. 897-928, DOI:10.1086/319347. URL consultato l'8 luglio 2018.
- ^ a b (EN) Ronel Pienaar, Albert W. H. Neitz e Ben J. Mans, Tick Paralysis: Solving an Enigma, in Veterinary Sciences, vol. 5, n. 2, 14 maggio 2018, p. 53, DOI:10.3390/vetsci5020053. URL consultato l'8 luglio 2018.
- ^ (EN) Overview of Tick Paralysis - Nervous System - Veterinary Manual, in Veterinary Manual. URL consultato il 13 luglio 2018.
- ^ (EN) Experimentally induced tick toxicosis in rats bitten by Ornithodoros brasiliensis (Chelicerata: Argasidae): A clinico-pathological characterization, in Toxicon, vol. 88, 15 settembre 2014, pp. 99-106, DOI:10.1016/j.toxicon.2014.06.017. URL consultato l'11 luglio 2018.
- ^ (EN) José Reck, João Fábio Soares e Carlos Termignoni, Tick toxicosis in a dog bitten by Ornithodoros brasiliensis, in Veterinary Clinical Pathology, vol. 40, n. 3, 9 agosto 2011, pp. 356-360, DOI:10.1111/j.1939-165x.2011.00338.x. URL consultato l'11 luglio 2018.
- ^ Ben J Mans, Christiaan M.L Steinmann e Jacobus D Venter, Pathogenic mechanisms of sand tampan toxicoses induced by the tick, Ornithodoros savignyi, in Toxicon, vol. 40, n. 7, 2002-07, pp. 1007-1016, DOI:10.1016/s0041-0101(02)00098-3. URL consultato l'11 luglio 2018.
- ^ Taylor, M. A. (Mike A.), e Wall, Richard (Richard L.),, Veterinary parasitology, 4th edition, ISBN 978-1-119-07369-7, OCLC 907811634. URL consultato l'11 luglio 2018.
- ^ a b Giorgio Leigheb e Elisa Zavattaro, Dermatiti provocate da artropodi, SICS Editore, 19 settembre 2016, ISBN 978-88-6930-409-5. URL consultato il 7 luglio 2018.
- ^ (EN) Tick Allergy, in Australasian Society of Clinical Immunology and Allergy (ASCIA). URL consultato l'8 luglio 2018.
- ^ Sheryl van Nunen, Tick-induced allergies: mammalian meat allergy, tick anaphylaxis and their significance, in Asia Pacific Allergy, vol. 5, n. 1, 2015-1, pp. 3-16, DOI:10.5415/apallergy.2015.5.1.3. URL consultato l'8 luglio 2018.
- ^ Sandra R. Merchant e Joseph Taboada, Dermatologic Aspects of Tick Bites and Tick-Transmitted Diseases, in Veterinary Clinics of North America: Small Animal Practice, vol. 21, n. 1, 1991-01, pp. 145-155, DOI:10.1016/s0195-5616(91)50015-2. URL consultato l'8 luglio 2018.
- ^ Vidal Haddad, Michel Raineri Haddad e Mônica Santos, Skin manifestations of tick bites in humans, in Anais Brasileiros De Dermatologia, vol. 93, n. 2, 2018-3, pp. 251-255, DOI:10.1590/abd1806-4841.20186378. URL consultato l'8 luglio 2018.
- ^ (EN) Dermatologic Aspects of Tick Bites and Tick-Transmitted Diseases, in Veterinary Clinics of North America: Small Animal Practice, vol. 21, n. 1, 1º gennaio 1991, pp. 145-155, DOI:10.1016/S0195-5616(91)50015-2. URL consultato l'8 luglio 2018.
- ^ Manilla, Giulio, 1929-1997., Acari:Ixodida, 1. ed, Calderini, 1998, ISBN 88-8219-162-1, OCLC 41017617. URL consultato l'8 luglio 2018.
- ^ Sodikoff, Charles H. e Caldin, Marco., Medicina di laboratorio del cane e del gatto : guida pratica alle diagnosi di laboratorio, Masson, 1997, ISBN 88-214-2340-9, OCLC 876510708. URL consultato l'8 luglio 2018.
- ^ Richard Brown, R S. Lane e D T. Dennis, Geographic distributions of tick-borne diseases and their vectors, 1º gennaio 2005, pp. 363-391. URL consultato l'8 luglio 2018.
- ^ Karen L. Mansfield, Lv Jizhou e L. Paul Phipps, Emerging Tick-Borne Viruses in the Twenty-First Century, in Frontiers in Cellular and Infection Microbiology, vol. 7, 11 luglio 2017, DOI:10.3389/fcimb.2017.00298. URL consultato l'8 luglio 2018.
- ^ a b Muriel Vayssier-Taussat, Maria Kazimirova e Zdenek Hubalek, Emerging horizons for tick-borne pathogens: from the ‘one pathogen–one disease’ vision to the pathobiome paradigm, in Future Microbiology, vol. 10, n. 12, 2015-12, pp. 2033-2043, DOI:10.2217/fmb.15.114. URL consultato l'8 luglio 2018.
- ^ Junming Shi, Zhihong Hu e Fei Deng, Tick-Borne Viruses, in Virologica Sinica, vol. 33, n. 1, 2018, pp. 21-43, DOI:10.1007/s12250-018-0019-0. URL consultato l'8 luglio 2018.
- ^ Tick-Borne Diseases: Overview, Biology and Life Cycle of Ticks, Guidelines on the Diagnosis and Management of Tickborne Rickettsial Diseases, 21 giugno 2017. URL consultato l'8 luglio 2018.
- ^ a b Ministero della Sanità Circolare n. 10 del 13 luglio 2000 Malattie trasmesse da zecche: cenni di epidemiologia - misure di prevenzione (PDF), su salute.gov.it. URL consultato l'11 luglio 2018 (archiviato dall'url originale il 17 aprile 2018).
- ^ Cringoli, Giuseppe., Zecche (PDF), Rolando Editore, [2005], ISBN 88-89132-05-1, OCLC 963873591. URL consultato il 9 luglio 2018.
- ^ Ministero della sanità: Circolare n. 19 del 10 luglio 1995 - Misure di prevenzione nei confronti di malattie trasmesse da artropodi: Malattia di Lyme; Encefalite da zecche. (PDF), su trovanorme.salute.gov.it.
- ^ a b c Roberto Cagarelli e Alba Carola Finarelli - Servizio sanità pubblica della Regione Emilia-Romagna, Giulia Maioli - Istituto zooprofilattico sperimentale della Lombardia e dell’Emilia-Romagna. - Zecche: caratteristiche del parassita, misure di protezione e prevenzione (PDF), su salute.regione.emilia-romagna.it.
- ^ L. Zenner, E. Drevon-Gaillot e M. P. Callait-Cardinal, Evaluation of four manual tick-removal devices for dogs and cats, in Veterinary Record, vol. 159, n. 16, 14 ottobre 2006, pp. 526-529, DOI:10.1136/vr.159.16.526. URL consultato l'11 luglio 2018.
- ^ (DE) Wie wird eine Zecke richtig entfernt?, su lgl.bayern.de. URL consultato il 14 luglio 2018.
- ^ Pär Comstedt, Wolfgang Schüler e Andreas Meinke, The novel Lyme borreliosis vaccine VLA15 shows broad protection against Borrelia species expressing six different OspA serotypes, in PLoS ONE, vol. 12, n. 9, 1º settembre 2017, DOI:10.1371/journal.pone.0184357. URL consultato l'11 luglio 2018.
- ^ WHO | Tick-borne Encephalitis Vaccine, su who.int. URL consultato l'11 luglio 2018.
- ^ Istituto Poligrafico e Zecca dello Stato S.p.A., MINISTERO DELLA SANITÀ Decreto Ministeriale 11 febbraio 1997, su trovanorme.salute.gov.it. URL consultato l'11 luglio 2018.
Bibliografia
[modifica | modifica wikitesto]- Sonenshine, Daniel E., e Roe, R. Michael,, Biology of ticks. Volume 1, Second edition, ISBN 978-0-19-937927-9, OCLC 862106136.
- Sonenshine, Daniel E. e Roe, R. Michael., Biology of ticks, Volume 2, 2nd ed, Oxford University Press, 2014, ISBN 978-0-19-974405-3, OCLC 819641605.
- Goodman, Jesse L., Dennis, David T. (David Tappen), 1939- e Sonenshine, Daniel E., Tick-borne diseases of humans, ASM Press, 2005, ISBN 1-55581-238-4, OCLC 56614466.
Voci correlate
[modifica | modifica wikitesto]- Virus trasmessi da zecche
- Malattia di Lyme
- Encefalite trasmessa da zecche
- Tularemia
- Paralisi da zecca
- Febbre emorragica Congo-Crimea
- Febbre ricorrente
- Babesiosi
- Febbre bottonosa
- Febbre maculosa delle Montagne Rocciose
- Ixodida
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su malattie trasmesse dalle zecche
Wikimedia Commons contiene immagini o altri file su malattie trasmesse dalle zecche
| Controllo di autorità | Thesaurus BNCF 70208 · LCCN (EN) sh86002246 · BNF (FR) cb13602660m (data) · J9U (EN, HE) 987007546452905171 |
|---|