Decarbossilazione
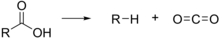
In chimica una decarbossilazione è una reazione che porta alla perdita di una molecola di anidride carbonica secondo lo schema:
In biochimica
[modifica | modifica wikitesto]Nel metabolismo degli esseri viventi è una reazione molto comune, viene solitamente catalizzata da una classe di enzimi chiamata decarbossilasi (o più formalmente carbossi-liasi, facenti parte della sotto-sottoclasse enzimatica EC 4.1.1), i cui substrati sono in genere amminoacidi che vengono trasformati in ammine.
Comuni decarbossilazioni di amminoacidi ad ammine sono:
- da triptofano a serotonina;
- da fenilalanina a feniletilammina;
- da tirosina a noradrenalina;
- da istidina a istamina;
- da serina a etanolammina;
- da acido glutammico a GABA;
- da lisina a cadaverina;
- da arginina ad agmatina;
- da ornitina a putrescina;
- da L-DOPA a dopamina.
Altre decarbossilazioni importanti dal punto di vista metabolico sono quelle previste dal ciclo di Krebs:
- dal piruvato ad acetil coenzima A;
- da ossalosuccinato ad α-chetoglutarato;
- da α-chetoglutarato a succinil-CoA.
In chimica organica
[modifica | modifica wikitesto]In chimica organica la reazione di decarbossilazione corrisponde ad un accorciamento della catena dello scheletro di atomi di carbonio. La reazione è stata studiata approfonditamente già agli inizi del XX secolo, soprattutto la decarbossilazione degli aminoacidi al fine di imitare sinteticamente ciò che avveniva a livello biochimico, e con l'intento di sfruttare risorse naturali ampiamente disponibili[1].
- Generalmente la decarbossilazione di un acido carbossilico richiede il riscaldamento della sostanza ad alte temperature (superiori ai 200 °C) miscelata con un liquido altobollente in cui risulti insolubile. Possono essere usati olii minerali, glicerolo, difenilmetano, acenaftene[2], scelti in funzione della polarità dell'acido. Gli acidi carbossilici più semplici non reagiscono[3]. Per migliorare le rese e la cinetica di reazione possono essere usati catalizzatori come sali di rame, chetoni altobollenti come cicloesanone seppure in questo caso si possa avere formazione di sottoprodotti indesiderati[4].
Relativamente facile è invece la decarbossilazione degli β-cheto-acidi, e dell'acido malonico o dei suoi derivati per via della formazione di un intermedio ciclico particolarmente stabile. Tale reazione può essere effettuata scaldando l'acido dicarbossilico o il chetoacido a 150 °C per varie ore. Si veda anche la condensazione di Knoevenagel.
- Anche scaldando l'acido carbossilico con soda caustica [5] o scaldando l'estere corrispondente con acido cloridrico [6] si possono ottenere prodotti decarbossilati. Per la decarbossilazione degli esteri si veda anche la decarbossilazione d Krapcho.
- Altre decarbossilazioni coinvolgono intermedi radicalici come nella decarbossilazione di Barton, nella reazione di Kolbe, nella reazione di Hunsdiecker.
Note
[modifica | modifica wikitesto]- ^ Treat B. Johnson, P.G. Daschavsky, J. Biol. Chem., 1925, 35, p.725 e sgg, X, THE FORMATION OF TYRAMINE BY DECARBOXYLATION OF TYROSINE PRODUCED FROM SILK.
- ^ F. Graziani, Atti. accad. Lincei, 1915, xxiv, series 5, pt. 1, 822, 936.
- ^ http://www.chem.ucalgary.ca/courses/350/Carey5th/Ch19/ch19-3-4.html, Decarboxylation, Dr. Ian A. Hunt, Department of Chemistry, University of Calgary
- ^ https://www.erowid.org/archive/rhodium/chemistry/tryptophan.html, Tryptamine from Tryptophan
- ^ Jim Clark, The Decarboxylation of Carboxylic Acids and their Salts, su chemguide.co.uk, Chemguide, 2004. URL consultato il 22 ottobre 2007.
- ^ Malonic Ester Synthesis, su organic-chemistry.org, Organic Chemistry Portal. URL consultato il 26 ottobre 2007.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «decarbossilazione»
Wikizionario contiene il lemma di dizionario «decarbossilazione» Wikimedia Commons contiene immagini o altri file su decarbossilazione
Wikimedia Commons contiene immagini o altri file su decarbossilazione