Nitrili

I nitrili sono composti organici caratterizzati dal gruppo funzionale −C≡N.[1] Nella letteratura industriale al termine nitrile si preferisce il prefisso ciano-. I nitrili sono costituenti di materiali di uso comune come le colle cianoacriliche e la gomma nitrilica usata in guanti da laboratorio e in sigillanti per uso automobilistico.
I composti inorganici contenenti il gruppo −C≡N sono chiamati, invece, cianuri. Sia i nitrili che i cianuri si possono considerare derivati di cianuri salini tipo NaCN e KCN, ma in genere i nitrili sono meno tossici.
Il gruppo funzionale −C≡N non va confuso col gruppo −N≡C, caratteristico degli isocianuri.
Struttura e proprietà di base
[modifica | modifica wikitesto]Nei nitrili il gruppo R−C≡N ha geometria lineare, dato che il carbonio con legame triplo è ibridato sp. La distanza C−N è corta (116 pm),[2] in accordo con la presenza di un legame triplo. I nitrili sono composti polari, come segnalato da valori elevati di momento dipolare. In fase liquida hanno permittività elettrica elevata.
Storia
[modifica | modifica wikitesto]L'acido cianidrico, nitrile dell'acido formico, fu il primo nitrile ad essere sintetizzato, ad opera di Carl Scheele nel 1782.[3][4] Nel 1811 Joseph Louis Gay-Lussac riuscì a preparare acido cianidrico puro, composto molto tossico e volatile.[5] Nel 1832 Friedrich Wöhler e Justus von Liebig prepararono il cianuro di benzoile e il benzonitrile, ma data la resa bassissima non poterono determinarne le proprietà chimiche e fisiche, né proporne la struttura.[6] Nel 1834 Théophile-Jules Pelouze sintetizzò il propionitrile.[7] Nel 1844 Hermann von Fehling sintetizzò il benzonitrile, riuscendo per la prima volta a isolare una quantità sufficiente per determinarne la struttura. Coniò il termine nitrile che venne da allora usato per designare questo gruppo di sostanze.[8] In seguito, per circa un secolo le ricerche in questo campo restarono scarse, presumibilmente a causa della tossicità di questi composti. A partire dagli anni 1940 vari cianuri inorganici furono facilmente disponibili, e i nitrili organici diventarono prodotti chimici di grande tonnellaggio[non chiaro].[3]
Sintesi industriali
[modifica | modifica wikitesto]Industrialmente, i metodi principali per la sintesi di nitrili sono ammonossidazione e idrocianazione.
Ammonossidazione
[modifica | modifica wikitesto]L'ammonossidazione è la parziale ossidazione di un idrocarburo in presenza di ammoniaca e opportuni catalizzatori, di solito a base di vanadio e molibdeno. Questo processo è utilizzato su larga scala per la sintesi di acrilonitrile a partire da propene:
- CH2=CH–CH3 + 3⁄2O2 + NH3 → CH2=CH–CN + 3H2O
In questo processo si forma anche acetonitrile come prodotto secondario. L'ammonossidazione è usata su scala industriale per produrre anche altri nitrili, tra i quali derivati di benzonitrile, ftalonitrile e isobutironitrie.[9]
Idrocianazione
[modifica | modifica wikitesto]Questo metodo forma nitrili addizionando cianuro di idrogeno o ioni cianuro ad alcheni. Un esempio tipico è la idrocianazione di 1,3-butadiene per formare adiponitrile, precursore del nylon 6,6:[9]
- CH2=CH−CH=CH2 + 2HCN → NC(CH2)4CN
Sintesi di laboratorio
[modifica | modifica wikitesto]Su scala di laboratorio sono possibili svariate sintesi.[3][9] Alcune sono:
Sintesi di Kolbe
[modifica | modifica wikitesto]La sintesi di Kolbe è basata sulla sostituzione nucleofila di un alogenuro alchilico con cianuro di sodio o di altri metalli alcalini. La reazione è detta di ciano-dealogenazione.
- R−CH2−X + NaCN → R−CH2−CN + NaX
Disidratazione di ammidi e ossime
[modifica | modifica wikitesto]La disidratazione di un'ammide primaria (R-CO-NH2) con rimozione di una molecola d'acqua porta al nitrile. Ad esempio la benzammide è convertita a benzonitrile in presenza di diclorofosfato di etile e DBU. Come intermedi della reazione si formano il tautomero A e il suo addotto fosfato B.[10]
Anche la disidratazione di aldossime (RCH=NOH) porta ai nitrili. Reagenti tipici per questa reazione sono trietilammina/diossido di zolfo, zeoliti o cloruro di solforile. Questo approccio è sfruttato nella sintesi one-pot di nitrili a partire da aldeidi e idrossilammina:[11]
Reazione di Sandmeyer
[modifica | modifica wikitesto]La reazione di Sandmeyer può essere sfruttata per ottenere nitrili aromatici a partire dall'anilina. La reazione procede via sali di diazonio e richiede cianuri dei metalli di transizione.[12]
- ArN2+ + CuCN → ArCN + N2 + Cu+
Reazione di Rosenmund-von Braun
[modifica | modifica wikitesto]Anche la reazione di Rosenmund-von Braun porta a nitrili aromatici, trattando alogenuri arilici con cianuro di rame(I).[13]
Altri metodi
[modifica | modifica wikitesto]- La trasformazione di N,N'-dialchilidrazoni in nitrili è una reazione molto facile ed efficiente. Si ottiene trattando il N,N-dialchilidrazone con perossido di idrogeno al 30%, in un solvente misto acetonitrile-acido acetico-piridina in rapporto 94,5-5-0,5 ed in presenza dell'1% di metiltriossorenio come catalizzatore. La trasformazione rapida dell'idrazone in nitrile è del 90%. La reazione è generale in quanto avviene con idrazoni delle aldeidi alifatiche, aromatiche ed anche insature ed eterocicliche.[14]
- RHC=N-N(CH3)2 + H2O2 RCN
- I nitrili si possono ottenere anche per ossidazione di ammine primarie. L'ossidazione si può condurre con perossidisolfato di potassio,[15] acido tricloroisocianurico,[16] o per elettrosintesi anodica.[17]
- Nitrili aromatici possono essere ottenuti a partire da chinoni usando trimetilsililcianuro. La cianidrina sililata intermedia viene resa aromatica con tribromuro di fosforo.[18]
Reazioni
[modifica | modifica wikitesto]Nei nitrili il gruppo –CN ha proprietà elettrofile. Nei nitrili alifatici il carbonio adiacente al gruppo –CN può dare reazioni di sostituzione catalizzate da basi.
Il gruppo nitrile di un composto organico può dar luogo a varie reazioni a seconda delle condizioni e dei reagenti presenti.
Idrolisi
[modifica | modifica wikitesto]I nitrili possono essere idrolizzati ai corrispondenti acidi carbossilici. Un acido così ottenuto sarà caratterizzato dall'avere un carbonio in più rispetto all'alogenuro alchilico da cui il nitrile è stato sintetizzato. Il passaggio attraverso il nitrile consente quindi di allungare di un'unità la catena di atomi di carbonio di un substrato.
- R-CH2-CN + 2 H2O + OH– → R-CH2-COO– + NH4OH
Riduzione
[modifica | modifica wikitesto]La riduzione dei nitrili con idrogeno porta alla formazione di ammine. A seconda delle condizioni, si possono ottenere anche ammine secondarie e terziarie:[19]
- R-C≡N + 2H2 → R-CH2NH2
- 2R-C≡N + 4H2 → (R-CH2)2NH + NH3
- 3R-C≡N + 6H2 → (R-CH2)3N + 2NH3
Si possono usare vari altri riducenti, tipo tetraidroalluminato di litio, boroidruro di litio,[20] diborano[21] o sodio elementare.[22]
Alchilazione
[modifica | modifica wikitesto]I nitrili alchilici sono abbastanza acidi da formare carbanioni nitrilici, cioè specie che hanno perso un protone dal carbonio in α al gruppo nitrile, e che possono alchilare una vasta varietà di elettrofili.[23] L'eccezionale nucleofilia di queste specie è dovuta ai bassi requisiti sterici dell'unità CN e alla sua stabilizzazione induttiva. Per questi motivi i nitrili sono ideali in sintesi di chimica farmaceutica per formare nuovi legami carbonio-carbonio in presenza di stringenti requisiti sterici. Recenti sviluppi hanno mostrato che la natura del controione metallico può provocare differenti coordinazioni all'azoto del nitrile o all'adiacente carbonio nucleofilo, con profonde conseguenze su reattività e stereochimica.[24]
Addizione nucleofila
[modifica | modifica wikitesto]Il carbonio nitrilico è elettrofilo, ed è quindi suscettibile di addizione nucleofila. Esempi sono:
- La reazione di Blaise con reattivi di organo-zinco
- La reazione di Pinner con alcoli
- La reazione di Houben-Hoesch con composti aromatici per formare arilchetoni.
- Nella reazione di Thorpe i nitrili alifatici danno auto-condensazione per formare enammine.[25]
- Con amine, come la sintesi di creatina a partire da sarcosina e cianammide[26]
Altre reazioni
[modifica | modifica wikitesto]- I nitrili possono anche reagire con i reattivi di Grignard formando chetoni attraverso la formazione di una immina intermedia che viene sottoposta a idrolisi:
- R-CN + R'-MgX → R-C(NH)-R' → R-CO-R'
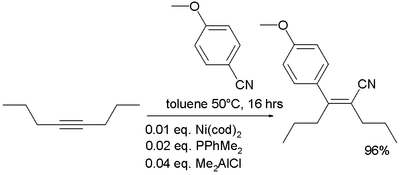
- I nitrili possono addizionarsi agli alchini in presenza di catalizzatori.[27]
- I nitrili sono precursori di complessi nitrilici dei metalli di transizione usati come reagenti e catalizzatori. Alcuni esempi sono [Cu(MeCN)4]+ e PdCl2(PhCN)2.[28]
Nitrili di uso comune
[modifica | modifica wikitesto]Un nitrile usato molto in laboratorio è l'acetonitrile (CH3-CN), adoperato come solvente biologico mescolato con una soluzione tampone, per estrarre metaboliti da tessuti e misurarne la concentrazione attraverso la cromatografia.
L'acrilonitrile è utilizzato principalmente come monomero per la produzione di polimeri sintetici, specialmente il poliacrilonitrile per fibre acriliche. È anche un componente della gomma sintetica.
Presenza in natura
[modifica | modifica wikitesto]I nitrili si trovano in natura in svariati vegetali e animali. Oltre 120 nitrili sono stati isolati da fonti terrestri e marine. I nitrili si trovano comunemente nell'endocarpo di alcuni frutti, in particolare nelle mandorle, e si sviluppano durante la cottura delle colture del genere Brassica (come cavoli, cavoletti di Bruxelles e cavolfiori) che rilasciano nitrili attraverso l'idrolisi. Il mandelonitrile è la cianidrina che rilascia cianuro in seguito all'ingestione di mandorle o altri semi di frutta.[29]
Applicazioni in farmacologia
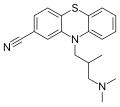
[modifica | modifica wikitesto]Sono attualmente commercializzati oltre 30 prodotti farmaceutici contenenti nitrile con svariate indicazioni medicinali, e in ricerche cliniche ci sono più di 20 altri derivati contenenti nitrile. Il gruppo nitrile è abbastanza robusto e, nella maggior parte dei casi, non è facilmente metabolizzato e passa invariato attraverso il corpo.[30] Alcuni prodotti farmaceutici contenenti nitrili sono vildagliptin, un farmaco antidiabetico, e anastrozolo, usato nel trattamento del cancro al seno. Altri farmaci contenenti il gruppo nitrile sono illustrati nella galleria.
-
Struttura della periciazina, un antipsicotico studiato nel trattamento delle dipendenze da oppiacei.
-
Struttura of ciamemazina, un antipsicotico.
Note
[modifica | modifica wikitesto]- ^ McNaught e Wilkinson 1997
- ^ Ken-ichi et al. 1974
- ^ a b c Mowry 1948
- ^ Scheele 1789
- ^ Gay-Lussac 1811
- ^ Wöhler e Liebig 1832
- ^ Pelouze 1834
- ^ Fehling 1844
- ^ a b c Pollak e Romeder 2002
- ^ Kuo et al. 2007
- ^ Dewan et al. 2006
- ^ Clarke e Read 2003
- ^ Koelsch e Whitney 1941
- ^ S. Stanković e Espenson 1998
- ^ Yamazaki e Yamazaki 1990
- ^ Chen et al. 2003
- ^ Feldhues e Schäfer
- ^ Glöcklhofer et al. 2015
- ^ Barrault e Pouilloux 1997
- ^ Soai e Ookawa 1986
- ^ Hutchins e Maryanoff 1973
- ^ Suter e Moffett 1934
- ^ Adams 1957
- ^ Fleming e Zhang
- ^ Schaefer e Bloomfield 2011
- ^ Smith e Tan 2006
- ^ Nakao et al. 2007
- ^ Rach e Kühn 2009
- ^ Fleming 1999
- ^ Fleming et al. 2010
Bibliografia
[modifica | modifica wikitesto]- (EN) R. Adams (a cura di), Organic Reactions, Volume 9, New York, John Wiley & Sons, 1957, ISBN 978-0471007265.
- (EN) J. Barrault e Y. Pouilloux, Catalytic Amination Reactions: Synthesis of fatty amines. Selectivity control in presence of multifunctional catalysts, in Catalysis Today, vol. 37, n. 2, 1997, pp. 137-153, DOI:10.1016/S0920-5861(97)00006-0.
- (EN) F.-E. Chen, Y.-Y. Kuang, H.-F. Dai, L. Lu e M. Huo, A Selective and Mild Oxidation of Primary Amines to Nitriles with Trichloroisocyanuric Acid, in Synthesis, vol. 17, 2003, pp. 2629-2631, DOI:10.1055/s-2003-42431.
- (EN) H. T. Clarke e R. R. Read, o-Tolunitrile and p-Tolunitrile, in Org. Synth., 2003, p. 69, DOI:10.1002/0471264180.os004.25.
- (EN) S. K. Dewan, R. Singh e A. Kumar, One pot synthesis of nitriles from aldehydes and hydroxylamine hydrochloride using sodium sulfate (anhyd) and sodium bicarbonate in dry media under microwave irradiation, in Arkivoc(ii), 2006, pp. 41-44.
- (DE) H. Fehling, Ueber die Zersetzung des benzoësauren Ammoniaks durch die Wärme, in Justus Liebigs Ann. Chem., vol. 49, 1844, pp. 91-97, DOI:10.1002/jlac.18440490106.«Da Laurent den von ihm entdeckten Körper schon Nitrobenzoyl genannt hat, auch schon ein Azobenzoyl existirt, so könnte man den aus benzoësaurem Ammoniak entstehenden Körper vielleicht Benzonitril nennen»
- (EN) U. Feldhues e H. J. Schäfer, Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode, in Synthesis, vol. 2, 1982, pp. 145-146, DOI:10.1055/s-1982-29721.
- (EN) F. F. Fleming, Nitrile-containing natural products, in Nat. Prod. Rep., vol. 16, 1999, pp. 597-606, DOI:10.1039/A804370A.
- (EN) F. Fleming e Z. Zhang, Cyclic nitriles: tactical advantages in synthesis, in Tetrahedron, vol. 61, n. 4, 2005, pp. 747-789, DOI:10.1016/j.tet.2004.11.012.
- (EN) F. F. Fleming, L. Yao, P. C. Ravikumar, L. Funk e B. C. Shook, Nitrile-containing pharmaceuticals: efficacious roles of the nitrile pharmacophore, in J. Med. Chem., vol. 53, n. 22, 2010, pp. 7902-7917, DOI:10.1021/jm100762r.
- (FR) Gay-Lussac, Note sur l'acide prussique, in Annales de chimie, vol. 77, 1811, pp. 128-133.
- (EN) F. Glöcklhofer, M. Lunzer e J. Frölich, Facile Synthesis of Cyanoarenes from Quinones by ReductiveAromatization of Cyanohydrin Intermediates, in Synlett., vol. 26, n. 7, 2015, pp. 950-952, DOI:10.1055/s-0034-1380150.
- (EN) R. O. Hutchins e B. E. Maryanoff, 2-tert-Butyl-1,3-diaminoproane, in Org. Synth., vol. 53, 1973, p. 21, DOI:10.15227/orgsyn.053.0021.
- (EN) K. Ken-ichi, F. Tsutomu e K. Kozo, Molecular Structures of Hydrogen Cyanide and Acetonitrile as Studied by Gas Electron Diffraction, in Bull. Chem. Soc. Jpn., vol. 47, n. 2, 1974, pp. 299-304, DOI:10.1246/bcsj.47.299.
- (EN) C. F. Koelsch e A. G. Whitney, The Rosenmund–von Braun nitrile synthesis, in J. Org. Chem., vol. 6, n. 6, 1941, pp. 795–803, DOI:10.1021/jo01206a002. URL consultato il 28 gennaio 2014.
- (EN) C.-W. Kuo, J.-L. Zhu, J.-D. Wu, C.-M. Chu e altri, A convenient new procedure for converting primary amides into nitriles, in Chem. Commun., n. 3, 2007, pp. 301-303, DOI:10.1039/b614061k.
- (EN) A. D. McNaught e A. Wilkinson, nitriles, in IUPAC. Compendium of Chemical Terminology (the "Gold Book"), 2ª ed., Oxford, Blackwell Scientific Publications, 1997, ISBN 0-9678550-9-8.
- (EN) D. T. Mowry, The Preparation of Nitriles, in Chem. Rev., vol. 42, n. 2, 1948, pp. 189-283, DOI:10.1021/cr60132a001.
- (EN) Y. Nakao, A. Yada, S. Ebata e T. Hiyama, A Dramatic Effect of Lewis-Acid Catalysts on Nickel-Catalyzed Carbocyanation of Alkynes, in J. Am. Chem. Soc., vol. 129, n. 9, 2007, pp. 2428-2429, DOI:10.1021/ja067364x.
- (DE) J. Pelouze, Notiz über einen neuen Cyanäther, in Ann. Pharm., vol. 10, 1834, p. 249, DOI:10.1002/jlac.18340100302.
- (EN) S. F. Rach e F. E. Kühn, Nitrile Ligated Transition Metal Complexes with Weakly Coordinating Counteranions and Their Catalytic Applications, in Chem. Rev., vol. 109, n. 5, 2009, pp. 2061-2080, DOI:10.1021/cr800270h.
- (EN) P. Pollak e G. Romeder, Nitriles, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a17_363.
- (EN) J. P. Schaefer e J. J. Bloomfield, The Dieckmann Condensation (Including the Thorpe-Ziegler Condensation), in Organic Reactions, vol. 15, n. 1, 2011, pp. 1-203, DOI:10.1002/0471264180.or015.01.
- (LA) C. W. Scheele, De materia tingente caerulei berolinensis, in Opuscula Chemica et Physica, II, Leipzig, J. G. Müller, 1789.
- (EN) A. L. Smith e P. Tan, Creatine Synthesis: An Undergraduate Organic Chemistry Laboratory Experiment, in J. Chem. Educ., vol. 83, n. 11, 2006, p. 1654, DOI:10.1021/ed083p1654.
- (EN) K. Soai e A. Ookawa, Mixed solvents containing methanol as useful reaction media for unique chemoselective reductions within lithium borohydride, in J. Org. Chem., vol. 51, n. 21, 1986, pp. 4000-4005, DOI:10.1021/jo00371a017.
- (EN) S. Stanković e J. H. Espenson, The MTO-catalyzed oxidative conversion of N,N-dimethylhydrazones to nitriles, in Chem. Commun., 1998, pp. 1579-1580, DOI:10.1039/A802723D.
- (EN) C. M. Suter e E. W. Moffett, The Reduction of Aliphatic Cyanides and Oximes with Sodium and n-Butyl Alcohol, in J. Am. Chem. Soc., vol. 56, n. 2, 1934, p. 487, DOI:10.1021/ja01317a502.
- (DE) F. Wöhler e J. Liebig, Untersuchungen über das Radical der Benzoesäure, in Ann. der Pharmacie, vol. 3, n. 3, 1832, pp. 249-282.
- (EN) S. Yamazaki e Y. Yamazaki, Nickel-catalyzed dehydrogenation of amines to nitriles, in Bull. Chem. Soc. Jpn., vol. 63, n. 1, 1990, pp. 301-303, DOI:10.1246/bcsj.63.301.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su nitrili
Wikimedia Commons contiene immagini o altri file su nitrili
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) nitrile, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4171932-3 · J9U (EN, HE) 987007531393905171 |
|---|



![{\displaystyle {\ce {->[{\text{metiltriossorenio cat.}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85c618ae4450d0bab930da30a6d2740bc9242b21)