Diossido di manganese
| Diossido di manganese | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| Biossido di manganese Ossido di manganese(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | MnO2 |
| Massa molecolare (u) | 86,94 |
| Aspetto | solido da grigio a nero |
| Numero CAS | |
| Numero EINECS | 215-202-6 |
| PubChem | 14801 |
| SMILES | O=[Mn]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,026 (20 °C) |
| Solubilità in acqua | (20 °C) insolubile |
| Temperatura di fusione | 535 °C (808 K) (decomposizione) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −520,9 |
| S0m(J·K−1mol−1) | 53,1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302+332 - 373 |
| Consigli P | 314 [1] |

Il diossido di manganese è l'ossido del manganese(IV). Il composto chimico ha formula MnO2, ma spesso è non stechiometrico.[2] È un solido inodore di colore da grigio a nero che si trova in natura nella pirolusite, il principale minerale da cui si estrae il manganese. È presente inoltre nei noduli di manganese sui fondali marini. L'uso principale di MnO2 è nelle pile, come nelle pile alcaline e in quelle zinco-carbone.[3] È molto usato anche nelle industrie dei laterizi e del vetro. In chimica, è il prodotto di partenza per produrre permanganato di potassio (KMnO4) e tutti gli altri composti di manganese. In sintesi organica è molto usato come ossidante.
Storia
[modifica | modifica wikitesto]I pittori rupestri dell'antichità, e in seguito gli antichi Egizi, usavano MnO2 come pigmento di colore nero o bruno. Uno dei primi utilizzi fu nella fabbricazione del vetro. Analisi condotte sui vetri dei Romani e degli Egizi hanno riscontrato la presenza di più del 2% di ossido manganoso. Plinio riporta che i Romani usano l'ossido di manganese (chiamato "magnes") per decolorare il vetro. Egli lo considerava una varietà di magnetite, un minerale magnetico di ferro.[4]
La pirolusite continuò ad essere scambiata per un ossido di ferro fino al 1740, quando J. H. Pott dimostrò che non conteneva ferro e che dava origine ad una serie di sali ben definita. Nel 1774 Carl Wilhelm Scheele dimostrò che era un ossido di un metallo e lo utilizzò per scoprire il cloro. MnO2 era usato nel XVIII secolo per la produzione di cloro. Il diossido di manganese era poi recuperato col processo Weldon. In seguito questa tecnologia è stata abbandonata, e attualmente il cloro è prodotto con metodi elettrolitici. Nel 1868 Georges Leclanché inventò la prima pila a secco dove MnO2 è usato come ossidante.[5]
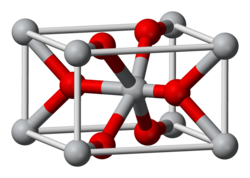
Struttura
[modifica | modifica wikitesto]Il diossido di manganese è spesso non stechiometrico. Sono stati identificati vari polimorfi di MnO2. Il più comune è la β-MnO2,(pirolusite) che ha una struttura analoga a quella del rutilo, TiO2.[6] Altri polimorfi sono α-MnO2, γ-MnO2, ε-MnO2, e λ-MnO2.[6][7] Le strutture di tutte queste forme sono simili, e sono basate su ottaedri MnO6 collegati; in tutti i casi tranne β-MnO2 ci sono tunnel che possono contenere cationi.[6][7]
Reattività
[modifica | modifica wikitesto]MnO2 è insolubile in acqua, ed è anche piuttosto inerte con la maggior parte degli acidi a temperatura ambiente. Per riscaldamento reagisce come ossidante, con reazioni diverse a seconda dell'acido usato. Con acido cloridrico (HCl) si sviluppa cloro; è il modo più semplice per preparare in laboratorio piccole quantità di cloro:
Con acido solforico concentrato a caldo il manganese si riduce a spese dell'ossigeno, che quindi si sviluppa: [3]
Sottoponendo MnO2 a fusione alcalina ossidante (fuso a caldo con basi forti come l'idrossido di potassio (KOH) in presenza di ossidanti od ossigeno) si ottiene lo ione manganato (MnO42−), di colore verde scuro. Questo è abbastanza stabile in soluzione basica, mentre in soluzione neutra o acida dismuta:
Anche lo ione permanganato (MnO4−) non è stabile indefinitamente in soluzione, e si riduce lentamente a MnO2 formando ossigeno:
Il diossido di manganese catalizza inoltre la decomposizione del perossido di idrogeno (H2O2) a ossigeno e acqua:
Usi
[modifica | modifica wikitesto]Pile
[modifica | modifica wikitesto]Attualmente, l'utilizzo principale di MnO2 è come componente ossidante sia nelle classiche pile a secco che nelle più moderne batterie alcaline. Per questo utilizzo nel 1976 sono state usate 500.000 tonnellate di pirolusite.[3] Nelle batterie non si usa MnO2 di origine naturale, bensì di sintesi. Esistono due forme sintetiche distinte: il diossido di manganese chimico (CMD = chemical manganese dioxide) e il diossido di manganese elettrolitico (EMD = electrolytic manganese dioxide).[8]
Laterizi
[modifica | modifica wikitesto]Un altro utilizzo importante di MnO2 è nell'industria dei laterizi per ottenere mattoni colorati.[3] I colori ottenibili spaziano dal giallo al rosso al bruno al nero, a seconda della quantità di MnO2 aggiunto e del colore iniziale del materiale argilloso. MnO2 può essere usato anche in miscela con altri ossidi, come gli ossidi di ferro.
Vetro
[modifica | modifica wikitesto]Da sempre usato nell'industria del vetro, MnO2 serve a "decolorare" il vetro, e per questo motivo è conosciuto anche come sapone dei vetrai.[3] Il vetro è spesso colorato per la presenza inevitabile di piccole quantità di ferro; ad esempio lo ione Fe2+ impartisce una colorazione verde. L'aggiunta all'impasto di MnO2 ha due effetti. Un primo effetto è ossidare il Fe2+ a Fe3+, che è molto meno colorato. Inoltre, il manganese si riduce a specie di Mn(III) che hanno un colore rosso, complementare a quello del ferro, per cui il vetro appare "incolore", anche se in realtà diventa grigio. Come decoloranti per il vetro si usano attualmente anche composti di selenio e cobalto.
Precursore del permanganato
[modifica | modifica wikitesto]La sintesi industriale del permanganato di potassio inizia con la fusione alcalina ossidante di MnO2: il solido è miscelato con una base forte come l'idrossido di potassio (KOH) e fuso a caldo in presenza di un ossidante come nitrato di potassio (KNO3) o anche di ossigeno:[8]
Il manganese viene così ossidato da Mn(IV) a Mn(VI), formando lo ione manganato (MnO42−) di colore verde scuro, che viene poi ossidato elettroliticamente a Mn(VII) per ottenere il permanganato di potassio di colore viola scuro:
Ossidante in sintesi organica
[modifica | modifica wikitesto]Il diossido di manganese è spesso usato come ossidante in sintesi organica.[9] L'efficacia del reagente dipende dal metodo di preparazione, come succede tipicamente in sistemi eterogenei, dove l'area superficiale è uno dei fattori importanti.[10] Il minerale pirolusite è poco reattivo, e di solito MnO2 è preparato trattando una soluzione acquosa di KMnO4 con un sale di Mn(II), in genere il solfato. Il MnO2 così ottenuto ossida gli alcoli allilici alle corrispondenti aldeidi:
cis-RCH=CHCH2OH + MnO2 → cis-RCH=CHCHO + “MnO” + H2O
La configurazione del doppio legame è mantenuta durante la reazione. Si può fare una reazione analoga anche con i corrispondenti alcoli acetilenici, ma le aldeidi propargiliche ottenute possono essere molto reattive. Anche alcoli benzilici o inattivati sono substrati adatti per questa reazione. Gli 1,2-dioli sono scissi da MnO2 a dialdeidi o dichetoni. Oltre a queste, ci sono numerose altre applicazioni di MnO2, che può essere utilizzato in reazioni come ossidazione di ammine e tioli, formazione di sistemi aromatici, e reazioni di accoppiamento ossidativo.
Note
[modifica | modifica wikitesto]- ^ scheda della sostanza su IFA-GESTIS Archiviato il 13 novembre 2019 in Internet Archive.
- ^ N. N. Greenwood e A. Earnshaw, Manganese, Technetium and Rhenium, in Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 1048, ISBN 0-7506-3365-4.
- ^ a b c d e (EN) N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- ^ E. C. Harder, Manganese deposits of the United States with sections on foreign deposits., in Bulletin - United States Geological Survey, 1910, pp. Item note no. 427. Original from Harvard University Digitized Aug 24, 2007.
- ^ Encyclopaedia Britannica 11th ed. 1911, volumi separati in formato Djvu e text (in inglese), su Internet Archive
- ^ a b c (EN) A. F. Wells, Structural Inorganic Chemistry, 5ª ed., Oxford Science Publications, 1984, ISBN 0-19-855370-6.
- ^ a b G. C. Fong, B. J. Kennedy, M. M. Elcombe, A powder neutron-diffraction study of λ-MnO2 and γ-MnO2 and of LiMn2O4., in Zeitschrift für Kristallographie, vol. 209, n. 12, 1994, pp. 941-945.
- ^ a b (EN) A. R. Reidies, "Manganese Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005.
- ^ (EN) G. Cahiez, M. Alami, R. J. K. Taylor, M. Reid, J. S. Foot, "Manganese Dioxide" in Encyclopedia of Reagents for Organic Synthesis, a cura di L. Paquette, New York, J. Wiley & Sons, 2004, DOI:10.1002/047084289.
- ^ J. Attenburrow, A. F. B. Cameron, J. H. Chapman, R. M. Evans, B. A. Hems, A. B. A. Jansen, T. Walker,, Titolo non indicato., in J. Chem. Soc., 1952, p. 1094.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su diossido di manganese
Wikimedia Commons contiene immagini o altri file su diossido di manganese
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Esempi di reazioni che usano MnO2, su organic-chemistry.org.
- (EN) International Chemical Safety Card 0175, su ilo.org.
- (EN) Tossicità del manganese nelle ceramiche, di Elke Blodgett, su ceramic-materials.com. URL consultato il 1º maggio 2019 (archiviato dall'url originale il 24 novembre 2004).
| Controllo di autorità | Thesaurus BNCF 31329 |
|---|







